爱游戏官网,爱游戏官网(中国)生命科学与医学部孙宝林教授课题组揭示了金黄色葡萄球菌一氧化氮合成酶NOS及其内源产生的NO通过介导靶蛋白的S-亚硝基化修饰以调控万古霉素耐药性发生的具体分子机制。研究成果以“Transcription tuned by S-nitrosylation underlies a mechanism forStaphylococcus aureusto circumvent vancomycin killing”为题于4月21日在线发表在《Nature Communications》杂志上。
金黄色葡萄球菌(Staphylococcus aureus)是人类主要致病细菌,由甲氧西林耐药性金黄色葡萄球菌(methicillin-resistantS. aureus,MRSA)引发的感染正严重威胁公共健康安全。万古霉素被认为是临床上治疗严重MRSA感染的最后一道防线,但是,其中度耐药性金黄色葡萄球菌(vancomycin-intermediateS. aureus,VISA)的频繁出现,为MRSA的感染治疗带来了巨大挑战。因此,深入解析金黄色葡萄球菌万古霉素耐药机制具有重要的临床意义。一氧化氮(nitric oxide,NO)可作为信号分子,首先在真核生物中被发现可由一氧化氮合成酶(nitric oxide synthase,NOS)内源产生,参与调节各种生理及免疫功能。NO被报道能对蛋白质半胱氨酸残基的巯基进行S-亚硝基化修饰,进而影响蛋白质的活性和功能。金黄色葡萄球菌中也被证实存在可以催化产生NO的NOS,该酶被报道参与调控金黄色葡萄球菌的万古霉素耐药性,但相关分子机制尚不明确。
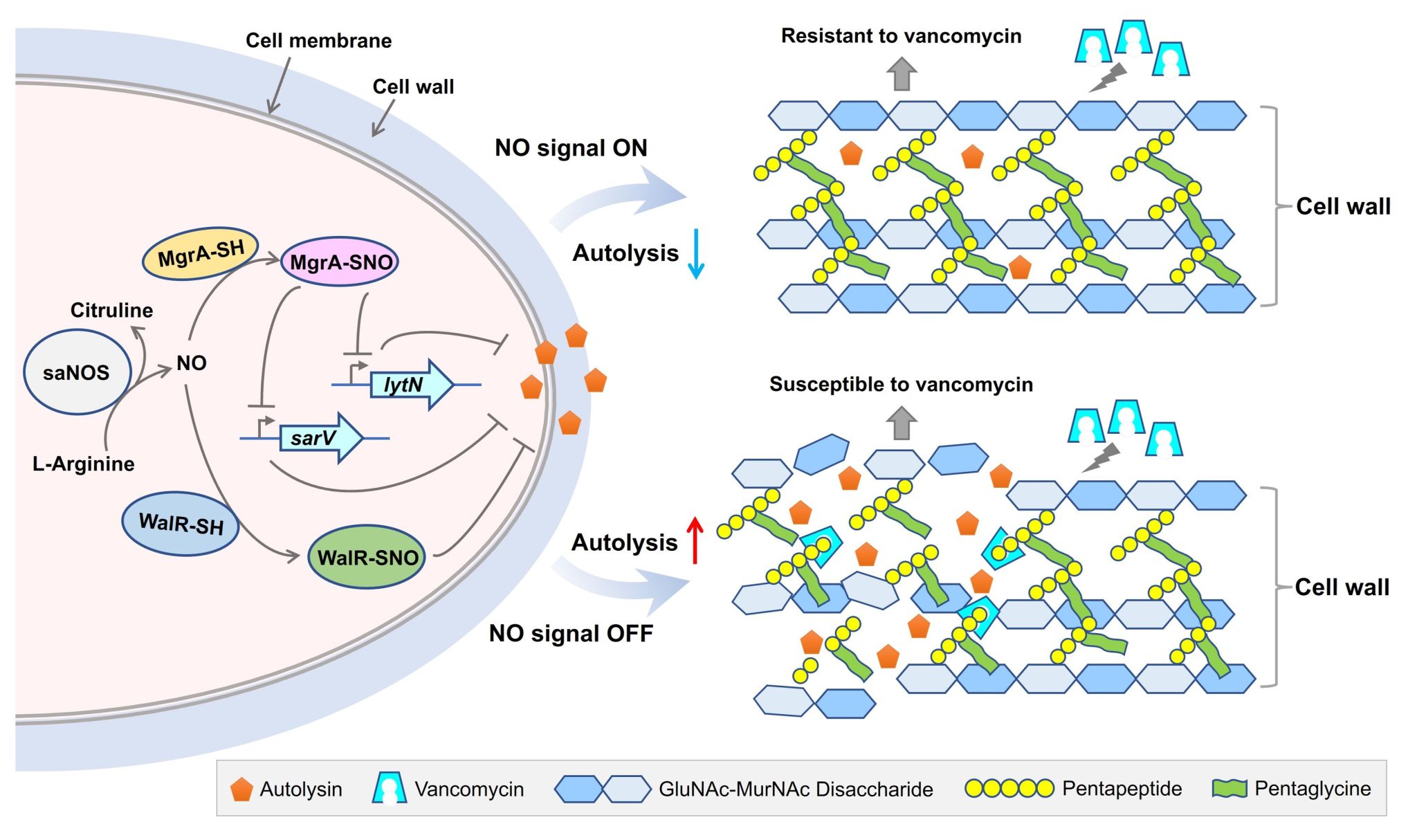
图1. NOS通过S-亚硝基化修饰介导万古霉素耐药性的分子机制。当存在内源NO时,MgrA和WalR发生S-亚硝基化修饰(SNO),促进对自溶相关靶基因的负调控功能,导致细胞的自溶活性下降,介导细胞壁厚度增加,进而促进金黄色葡萄球菌的万古霉素耐药性。
研究人员在临床VISA菌株XN108中,通过构建NOS突变菌株以及外源添加NOS抑制剂,证实了金黄色葡萄球菌NOS在万古霉素等细胞壁靶向抗生素抗性发生过程中的重要作用。接下来,利用蛋白质修饰组学的方法鉴定了金黄色葡萄球菌中可被内源NO亚硝基化修饰的靶标蛋白及相应位点。一个与抗生素抗性具有重要关联的转录因子MgrA上第12位的半胱氨酸发生了S-亚硝基化修饰,通过将半胱氨酸替换为不能被修饰的丝氨酸构建了mgrAC12S点突变菌株,发现NOS突变菌株类似,mgrAC12S突变菌株对万古霉素的抗性显著下降、细胞壁厚度显著下降以及细胞自溶活性增加。通过实时荧光定量PCR、凝胶阻滞迁移实验、染色质免疫共沉淀实验等方法,揭示了金黄色葡萄球菌NOS及其内源产生的NO在促进万古霉素抗性中的作用机制(图1):NOS来源的NO通过介导MgrA发生S-亚硝基化修饰,促进MgrA对自溶相关靶基因的负调控功能,导致细胞的自溶活性下降,介导细胞壁厚度增加,进而促进金黄色葡萄球菌的万古霉素耐药性。这种由NO介导的调控机制在另一个被鉴定到可发生S-亚硝基化修饰的转录因子WalR中得到了进一步的验证,表明金黄色葡萄球菌NOS内源产生的NO通过S-亚硝基化修饰介导的转录调控机制在细菌中可能具有普遍性。本研究有望为临床治疗VISA及其他细菌病原体的感染提供新的思路与策略。
本论文第一作者为孙宝林教授课题组的博士研究生舒雪琴,通讯作者为爱游戏官网,爱游戏官网(中国)孙宝林教授和北京儿童医院的于丹副研究员。该工作得到了科技部国家重点研发计划、国家自然科学基金、爱游戏官网,爱游戏官网(中国)中央高校基本科研业务费专项基金等项目的资助。
原文链接:https://www.nature.com/articles/s41467-023-37949-0
(生命科学与医学部、科研部)

